Foto: Albert Einstein - Instituto de Pesquisa
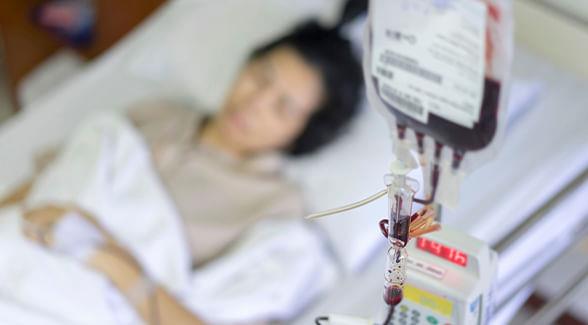
A notificação do Laboratórios Pierre Fabre do Brasil LTDA sobre a descontinuação da distribuição do medicamento bussulfano a partir de junho de 2021, indispensável para o transplante de medula óssea no Brasil, vem gerando preocupações em pacientes e profissionais da saúde. Único responsável pela comercialização do medicamento no País, o laboratório emitiu o anúncio no dia 23 de novembro e, mesmo após mais de um mês desde a notícia, ainda não há perspectivas sobre uma resolução.
Essencial para o sucesso do transplante de medula, o bussulfano atua destruindo as células doentes e preparando o organismo para as células saudáveis. O tratamento é recomendado principalmente para doenças relacionadas às doenças do sangue, como leucemia e linfomas, como também para transplante de órgãos.
“O bussulfano é uma droga essencial que a gente luta para que ela exista, se não não temo transplante de medula, que é um tratamento para leucemia, aplasia, nielodisplasia... Quando o indivíduo tem indicação de transplante [de medula óssea], não tem outra coisa a fazer: tem que transplantar, se não ele morre”, indica o doutor Fernando Barroso, professor da Universidade Federal do Ceará (UFC) e presidente eleito da Sociedade Brasileira de Transplante de Medula Óssea (SBTMO).
O caso passou a chamar ainda mais atenção após denúncia da atriz e jornalista Duda Riedel, que fez um fio na sua conta de Twitter explicando o caso. O post viralizou e vem ganhando apoio de influenciadores, artistas, profissionais de saúde e instituições. a jornalista descobriu uma leucemia em maio de 2019, quando tinha 24 anos, e em outubro conseguiu uma doadora 100% compatível. No Brasil, apesar de haver 5.265.919 pessoas cadastradas como doadoras (cerca de 203 mil no Ceará), 850 pessoas aguardam na fila por um doador, segundo dados do Registro Nacional de Doadores de Medula Óssea (Redome), banco de dados do Inca. A situação ocorre porque a compatibilidade é um dos principais desafios para os pacientes, elevando, assim, o tempo de espera.
A influenciadora criou uma petição no Avaaz, que na manhã desta quinta-feira, 7, já possuía mais de 179 mil assinaturas. “Eu sou transplantada de medula óssea e só estou aqui porque usei esse medicamento. Salvem os pacientes”, escreveu a jornalista. A frase “Salvem os pacientes" chegou a entrar nos assuntos mais comentados do Twitter nesta semana.
Com a situação, instituições como a Sociedade Brasileira de Transplante de Medula Óssea (SBTMO) e o Instituto Nacional de Câncer (Inca) entraram em contato com o Ministério da Saúde e a Anvisa para tentar buscar soluções para o caso. Entretanto, a resposta das instituições é que ainda estão buscando uma solução.
“A Anvisa respondeu que está tentando buscar alternativas junto ao Ministério. O que a gente gostaria é da agilidade dele, porque a gente não pode ficar uma semana sem o medicamento. Agilidade para que hospitais públicos e privados possam ter acesso a esse remédio, seja ele genérico, mesmo sem estar registrado no Brasil, mas que possa substituir. Outra alternativa seria o registro em tempo recorde”, indica o professor Fernando, ressaltando que, mesmo o laboratório Pierre Fabre indicando o fornecimento até junho de 2021, a data depende da demanda do número de transplantes.
A coluna Frisson entrou em contato com a Anvisa, que indicou que não possui instrumentos legais para impedir que o laboratório dê a descontinuidade ao remédio. A Agência indicou que protocolou um pedido de importação mas, por "questões comerciais, a transação não foi possível". Ainda, indicou que "verifica-se que a descontinuação de fabricação do medicamento não tem relação com pendências regulatórias e está fora da governança da Anvisa" (confira a nota na íntegra abaixo).
A Frisson também tentou entrar em contato com o Ministério da Saúde para conseguir atualizações do caso mas, até a publicação desta matéria, não havia recebido resposta.
Confira nota da Anvisa na íntegra:
Esclarecemos que a Anvisa não possui instrumento legal que impeça os laboratórios farmacêuticos de retirarem seus medicamentos do mercado. No entanto, dada a importância desse tema para a saúde pública, a Agência aprovou a RDC 18, de 04 de abril de 2014, que regulamenta a forma de comunicação de descontinuação de produção e importação de medicamentos. As empresas devem comunicar a descontinuação definitiva ou temporária de fabricação ou importação de medicamentos com pelo menos 180 dias de antecedência, devendo assegurar o fornecimento normal do produto durante esse período.
Nos casos de descontinuação não-programada da fabricação ou importação de medicamentos decorrente de fato imprevisto, a comunicação à Anvisa deverá ocorrer no prazo máximo de 72 h da ciência do problema. O desrespeito à norma sujeita os infratores às penalidades previstas na Lei nº 6.437, de 20 de agosto de 1977.
Ressalta-se que quando há indisponibilidade de um medicamento de extrema importância para o mercado, é possível a utilização do instrumento de importação excepcional, que pode ser solicitada à Anvisa, a qual irá avaliar a pertinência do pedido.
Quanto ao caso do medicamento bussulfano, a descontinuidade do fornecimento não está vinculada a nenhum pedido pendente junto à Anvisa, uma vez que houve comunicação de descontinuação por parte da empresa detentora do registro do medicamento na Anvisa devido ao encerramento da licença comercial do produto à Pierre Fabre, segundo informado pelo próprio laboratório à agência; e que a solicitação de importação em caráter excepcional foi autorizada pela Anvisa para evitar o desabastecimento, contudo, por questões comerciais, a transação não foi possível.
Destaca-se que todas as medidas cabíveis foram adotadas pela Agência, dentro de suas competências legais, tanto na determinação da regulamentação que deve ser seguida para aprovação e permanência de medicamentos e outros produtos de saúde no mercado brasileiro, quanto na avaliação de solicitação de importação em caráter excepcional; e, portanto, verifica-se que a descontinuação de fabricação do medicamento não tem relação com pendências regulatórias e está fora da governança da Anvisa.
Relatos
A nutricionista cearense Juliana Roma é mãe da pequena Lia, de 5 anos. A criança nasceu portadora de talassemia, doença herediária caracterizada pela redução das proteínas que carregam oxigênio no sangue. A família foi então para o banco de sangue, o Redome, e conseguiu um doador não aparentado. A menina não usou o bussulfano, tendo importado um outro medicamento da Itália, conhecida por ser um centro de tratamento da doença.
"Nós decidimos entrar nessa campanha proque nós fomos agraciados em poder importar essa medicação. Se a gente não tivesse, a Lia teria que usar o bussulfano, assim como milhares de pessoas precisam fazer, porque não tem nenhum outro medicamento compartível registrado pela Anvisa", indicou a nutricionista, que vem sendo uma das vozes do protesto no Ceará.